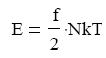molekulák között ún. intermolekuláris erő hat. Ez az erı fıként elektromos jellegő, és ha a
részecskéket túl közel akarjuk vinni egymáshoz a vonzás taszításba vált át. Ez az egyik oka,
amiért a folyadékokat nem tudjuk összenyomni. Az egyensúlyban lévı molekulának van
potenciális (helyzeti ), és kinetikus energiája. A kinetikus energia a hımérséklet emelésével
növekszik, elég magas hımérsékleten, pedig túllépheti a potenciális energiát. Ez a pont a
forráspont. Ha a hımérsékletet csökkentjük, akkor a kinetikus energiája alacsonyabb lesz,
megváltozik a molekula viselkedése. A folyadék megfagy.
Az ideális gázok kinetikus modellje: A molekulák mérete elhanyagolható a közöttük lévı
üres térrészhez képest. A részecskék egymással is és az edény falával is tökéletesen
rugalmasan ütköznek, az egyes ütközések között pedig egyenes vonalú egyenletes mozgással haladnak. A gázmolekulák rendezetlenül haladnak, és csak az ütközések pillanatában van közöttük kölcsönhatás.
Ezeket a feltételeket alkalmazva egy adott állapotban lévı gáz fontos fizikai jellemzıi
kifejezhetık a molekulák adataival.
Határozzuk meg a gáz nyomását egy adott tartáj falára, mint a molekulák
időegységkénti lendületváltozását egységnyi falfelületen.

de ha ki akarjuk terjeszteni a képletünket a tér mindhárom irányába, nemcsak x irányba,
akkor