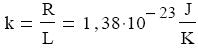egyértelműen meghatározzák a gáz egyensúlyi állapotát. Ezek a fizikai mennyiségek az
állapotjelzők vagy állapothatározók. Ezek közül a hőtani folyamatok során kiegyenlítendők ( pl.:p,T ) az intenzív, az összeadódók (pl.: m, V) pedig extenzív állapotjelzők. Bármelyik állapotjelző megváltoztatása legalább egy, de inkább több állapotjelző változását vonja maga után.
Az általános vagy egyesített gáztörvény megadja a kapcsolatot egy adott mennyiségű
ideális gáz állapotjelzői között, két különböző állapotban:
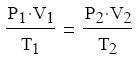
Az egyesített gáztörvényt, a kerületi feltételekből fakadóan csak az ideális gázoknál
tudjuk alkalmazni, és azt is csak nem túl magas nyomásig. A reális, többatomos gázokban a molekulák között a nyomás emelkedésével nő a vonzóerő, ezért a térfogat kisebb az elméleti értéknél. A reális gázok viselkedését a Van der Waals-féle állapotegyenlet írja le. Az általános gáztörvényben szereplő állandó értékét az Avogadro-törvény alapján határozhatjuk meg az ún. normálállapotban. Avogadro-törvénye szerint, minden gáz moláris tömegének ugyanannyi a térfogata normálállapotban, azaz 0°C hımérsékleten és 0,1 MPa nyomáson, mégpedig 22,41 liter. így a pV/T értékét erre az állapotra kiszámíthatjuk: 1 mol gáz esetén:
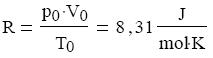
Az ideális gázok állapotegyenlete így kifejezhető az R gázállandó segítségével:
p×V = n×R×T, ahol n jelenti a molok számát. 1 mol anyagmennyiség,
L= 6,23×10^23 db molekulát tartalmaz. így az m tömegű gázban a molok száma n = m/M, azaz a molekulák száma: N=nL. Az állapotegyenletben n helyett N/L írható.
Az állapotegyenlet kifejezése a részecskeszámmal: pV=NkT
Ez a nevezetes Boltzmann-állandó: