végeznek, a kétatomos gázmolekulák viszont a haladó mozgáson kívül forognak is, mégpedig a két fő szimmetria tengely körül. Ezért hordoznak a kétatomos molekulák több energiát, mint az egyatomos gázok részecskéi. Ez az f-el jelölt szám a szabadsági fokok száma, amely tehát egyatomos gázokra f = 3, kétatomos gázokra f = 5, többatomos gázokra f = 6, mivel a kettőnél több atomos molekulák forgása 3 tengely körüli. Tehát a gázok belső energiája általánosan a következő alakban adható meg:
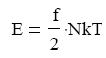
Az ekvipartíció tétele szerint, amely az energia egyenletes eloszlásának törvénye, a
gázmolekula minden egyes szabadsági fokára, ½ kT átlagos kinetikus energia jut.
A molekulák hőmozgását legegyszerőbben melegítéssel, hıközléssel növelhetjük. A
hőközlés mértékét, a hőmennyiséget a fizikában Q-val jelöljük. Ezen kívül a belső energiát, mechanikus munkavégzéssel is változtathatjuk ( W ). Ezen megfontolásokat figyelembe véve:
A termodinamika elsı főtétele szerint egy anyagi rendszer belső energiájának
megváltozása egyenlő a közölt hő és a rendszeren végzett mechanikai munka előjeles
összegével.
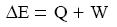
A tétel azt fejezi ki, hogy egy rendszeren belül semmiféle energia nem keletkezhet, vagy
tőnhet el. Tulajdonképpen ez a tétel zárja ki az ún. elsőfajú örökmozgó létezésének
lehetőségét, amely úgy adna le környezetének energiát, hogy közben a saját belső energiája nem csökkenne.


