Már Rutherford is feltételezte a kísérleti tapasztalatok alapján, hogy léteznie kell egy
olyan részecskének, amelynek az elektron töltésével egyezı abszolút értékő, pozitív töltése
van. Tömegét az atommagok osztályozásával lehetett megbecsülni, ha az elemek atomjainak
tömegét a hidrogénatom tömegével összehasonlították. A becsült érték az elektron tömegénél kb. 1840-szer nagyobbnak adódott.
Az elem rendszáma (Z) megadja a semleges atom külsı burkában lévı elektronok
számát, ill. a mag ezzel egyenlı pozitív töltéseinek számát.
Az elem relatív tömegszáma (A) azt fejezi ki, hányszor nagyobb tömegő az illetı elem
egy atomja a hidrogénatom tömegénél, ill. mai megfogalmazás szerint a 12-es szénizotópatom tömegének 12-ed része.
A proton feltételezése természetes volt, de a bizonyítékra 1925-ig várni kellett. A
kísérleti kimutatás P. Brackett nevéhez főzıdik, aki atommagok ütközéseit vizsgálta. Sikerült
rögzítenie azt az eseményt, amikor a nitrogénmag elnyelte az ütközı részecskét, s
protonkibocsátás mellett oxigénmaggá alakul át.
A neutron felfedezése
Rutherford a kísérleti tapasztalatok alapján elıször úgy képzelte (1910), hogy a Z
rendszámú magban A db proton és A-Z db elektron található, így válik kívülrıl semlegessé az atom és ezeket a Coulomb erı tartja össze. A Heisenberg-féle határozatlansági elv szerint azonban, ha az elektron a mag méretének megfelelı kis helyen tartózkodna, akkora
impulzussal rendelkezne, hogy azt a Coulomb-erı nem lenne képes felvenni, így felvetıdött
egy semleges részecske gondolata.
1930-ban berilliumot héliummagokkal bombáztak, és ennek hatására olyan sugarat
kaptak, amely vastag ólomlemezen is áthatol és nem ionizál, vagyis töltéssel nem rendelkezik. A sugárzás hatására a hidrogéntartalmú anyagból hihetetlen energiájú protonok léptek ki. A jelenséget Chadwick értelmezte 1932-ben, neutronok kilépésével, a következı reakció szerint:
2He4 + 4Be9 = 6C12 + 0n1.
A hélium- és berilliumatom találkozásakor tehát szén, és az eddig ismeretlen sugárzást
alkotó részecske, neutron keletkezett. Ez a felismerés tekinthetı a neutron felfedezésének.
A neutron ismeretében módosul az atom szerkezetérıl alkotott kép. A mag Z db protont
és A-Z db neutront tartalmaz, az atomburokban pedig Z db elektron kap helyet.
A nukleonok
A proton és a neutron, azaz a mag alkotói, közös neve a nukleonok.
A nukleonok sokkal nagyobb tömegőek, mint az elektron. A neutron kicsit nagyobb
tömegő a protonnál:mp = 1,672648 · 10-27 kg, mn = 1,674953 · 10-27 kg,
me = 9,10953 · 10-31 kg.
Eszerint az anyag igen szellıs felépítéső. Tömegének 99,98 %-a az atomok magjában,
nagyon kis helyen van összesőrősödve. A mag 16 nagyságrenddel sőrőbb, mint az
elektronburok.
Kiderült, hogy adott elem magjában, azonos protonszám mellett, különbözı számú
neutron lehet. A többféle elıfordulás miatt átlagos értékként kapjuk a törtszámmal kifejezett atomsúly értékét.
Egy adott elem különbözı tömegszámú atomjai, az illetı elem izotópjai.
A különbözı izotópok tehát kémiailag egyformán, de más szempontból (például
stabilitásukat tekintve) különbözıképpen viselkednek. Éppen ezért van jelentıségük a
magfizikai folyamatokban.
Erıs kölcsönhatás
Az atommagot összetartó erıhatás természetének teljes megértése az elméleti fizikusok
számára a mai napig sem lezárt problémakört képez. A gravitáció nem elég erıs. Az
elektromos vonzás nem jöhet szóba, hiszen a neutron semleges részecske, míg az egymáshoz
rendkívül közel elhelyezkedı protonok óriási erıvel taszítják egymást. Egy új típusú
kölcsönhatás jelenik meg tehát a nukleonok között, amelynek általános jellemzıi a
következıkben foglalhatók össze: - a kölcsönhatás elektromos töltéstıl független,
- bármely két nukleon között vonzás jellegő,
- erısebb, mint az elektromos,
- igen kis hatótávolságú, csak a közvetlenül szomszédos néhány nukleon között van.
Az atommag sőrősége
Hofstadter szórási kísérlete megerısítette Rutherford kísérletét és az atommag
nagyságrendje is egyezı volt. Azonban felfedezte, hogy egy átlagos nukleon sugara:
r0 = 1,2 · 10-15 m,
és a mag sugara, és térfogata evvel és a tömegszámmal kifejezhetı:
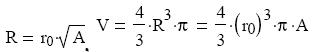
Tehát az atommag térfogata a tömegszámmal arányosnak bizonyult. Ez azt jelenti, hogy
a mag sőrősége nem nı a tömegszám növekedésével, mint az elektronburok sőrősége. Mint
látni fogjuk, ez a tapasztalat sugallta az energetikai leíráshoz az egyik lehetséges magmodellt, amely az atommagot az állandó sőrőségő, összenyomhatatlan folyadékcsepphez hasonlítja.




